ВенаЦиль
Берлин MVZ
и Франкфурт-на-Майне
Ваш центр медицины вен, проктологии, хирургии грыж, липоэдемы и эстетики — в центре Берлина и во Франкфурте-на-Майне.


Наши специализированные центры в одном взгляде
Самая современная медицина под одной крышей. Мы специализируемся на щадящих, минимально инвазивных процедурах в пяти специализированных областях.
В трех центральных офисах в Берлине-Митте мы работаем для Вас как официально признанный центр компетенции высочайшего качества, в том числе как центр компетенции по венам и по хирургии грыж с гарантией качества.

Официально признанный
Центр компетенции по венам
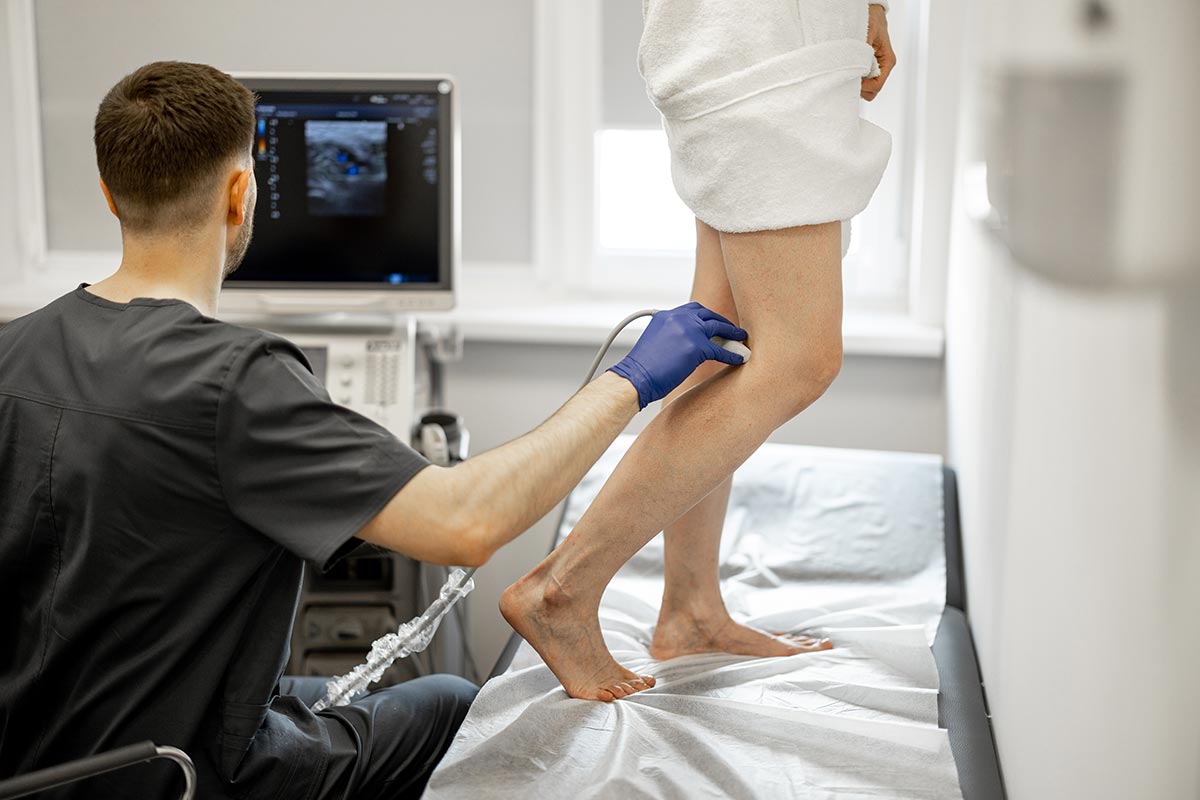
Мы специализируемся на лечении варикозного расширения вен, сосудистых звездочек, тромбоза, липоэдемы и комплексной терапии вен в наших берлинских центрах на Фридрихштрассе 95 и Шарлоттенштрассе 13.
Наши локации
Новинка: ВенаЦиль также во Франкфурте-на-Майне!
Наши специализированные центры в Берлине и Франкфурте предлагают Вам современную терапию вен, проктологию, лечение липоэдемы, хирургию грыж и эстетическую медицину — лично, минимально инвазивно и на короткие расстояния.
Эффективное лечение варикозного расширения вен с минимальным вмешательством — профессор доктор Харносс объясняет
Варикозное расширение вен — это не просто эстетическая проблема, оно может иметь серьезные последствия для здоровья. В этом видео профессор Д-р Харносс рассказывает о современных, щадящих методах лечения, таких как ВенаСил, которые позволяют добиться быстрых и эффективных результатов. Узнайте, как инновационные технологии могут улучшить качество Вашей жизни без длительных простоев.
Будьте в курсе: Новости о флебологии и проктологии
Наш блог содержит актуальную информацию о малоинвазивных методах лечения. Мы лечим варикозное расширение вен, геморрой и другие венозные и проктологические заболевания. Сюда входят новые методы лечения и экспертные знания из наших MVZ в Берлине и Франкфурте-на-Майне.